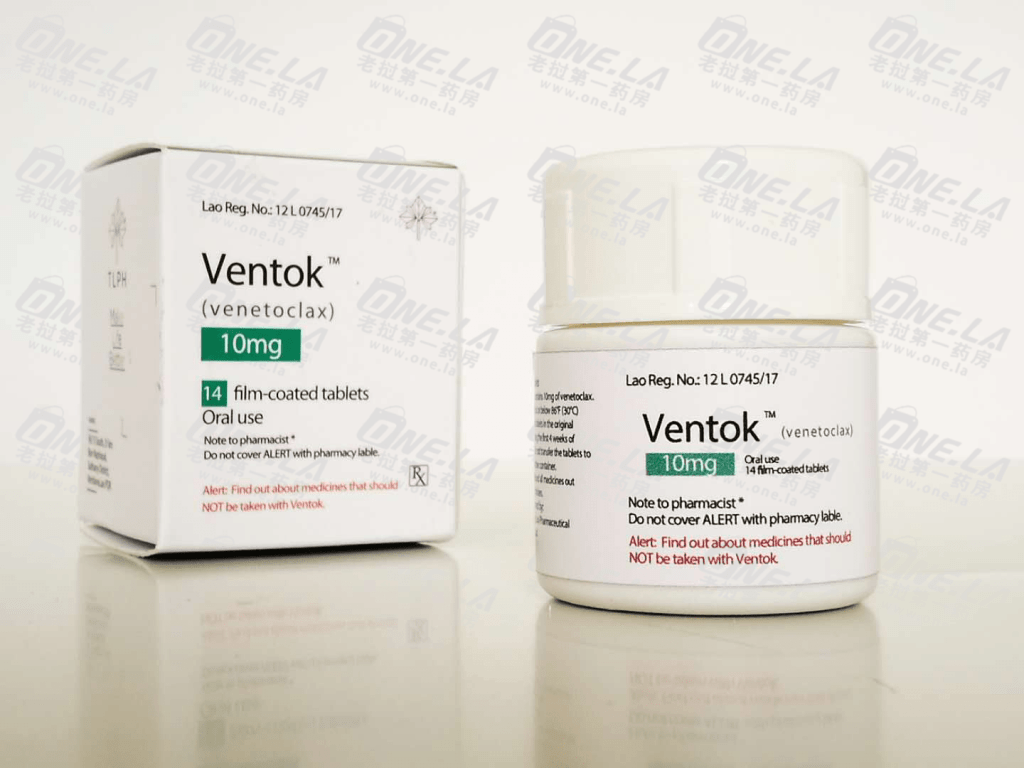
维奈克拉片(venetoclax)
全部名称:维奈托克,维奈克拉片,威托克,唯可来,Venclexta,venetoclax,Venclyxto
适应症:适用于染色体17p缺失或复发/难治性慢性淋巴细胞白血病(CLL)
价格:请咨询18011713438(微信同号)
维奈克拉片(venetoclax)说明书
通用名称:维奈托克
商品名称:唯可来
全部名称:维奈托克,维奈克拉片,威托克,唯可来,Venclexta,venetoclax,Venclyxto
适应症
适用于染色体17p缺失或复发/难治性慢性淋巴细胞白血病(CLL)。
贮藏
贮存在或低于86°F(30°C)。
规格片剂:10 mg,50 mg,100 mg
Venetoclax是BCL-2,一种抗凋亡蛋白的选择性和一种口服生物可利用小-分子抑制剂。曽证实在CLL细胞中BCL-2的过表达,它介导肿瘤细胞生存和被伴随对化疗抗力。Venetoclax通过与BCL-2蛋白直接结合帮助恢复凋亡过程,取代促凋亡蛋白像BIM,触发线粒体外膜通透化和半胱氨酸蛋白酶[caspases]的激活,在非临床研究中,venetoclax曽显示对过表达BCL-2肿瘤细胞细胞毒活性。
指导患者每天大约在同一时间,随餐和水服用VENCLEXTA(维奈克拉)片剂。VENCLEXTA(维奈克拉)片剂应整个吞服,不要在吞咽前咀嚼,压碎或破碎。
所有VENCLEXTA(维奈克拉)治疗方案均以5周的增量方式开始。
Venclexta 5周 剂量增加计划
评估患者特异性因素的肿瘤溶解综合症(TLS)风险水平,并在首次服用VENCLEXTA(维奈克拉)之前为患者提供预防性水合药物和抗高尿酸血症方案,以降低TLS 风险 。
VENCLEXTA(维奈克拉)建议每日给药剂量为400 mg。
5周的加速给药方案旨在逐步减少肿瘤负荷(减压)并减少TLS的风险。
1周 每日剂量VENCLEXTA(维奈克拉)20毫克
2周 每日剂量VENCLEXTA(维奈克拉)50毫克
3周 每日剂量VENCLEXTA(维奈克拉)100毫克
4 周 每日剂量VENCLEXTA(维奈克拉)200毫克
5 周 每日剂量VENCLEXTA(维奈克拉)400毫克
CLL / SLL 应根据加速计划提供VENCLEXTA(维奈克拉)的前4周启动包(10mg&50mg),启动完成后,使用100毫克片剂实现总计400毫克剂量的给药。
1、首次服用VENCLEXTA时,一定不要服用某些药物,而且由于TLS增加的风险,您的剂量会逐渐增加。
告诉您的医护人员您服用的所有药物,包括处方药和非处方药,维生素和草药补充剂。VENCLEXTA和其他药物可能会相互影响。
2、请勿在使用VENCLEXTA治疗期间开始使用新药。
3、在服用VENCLEXTA之前,请告知您的医疗保健提供者您的所有医疗状况,包括:有肾脏问题、你的身体盐或电解质有问题,如钾,磷或钙、有血液或痛风中高尿酸水平的病史。
4、在使用VENCLEXTA治疗之前,期间或之后,您不应该接受“活疫苗”,如果您不确定免疫接种或疫苗类型,请咨询您的主治医生。在使用VENCLEXTA治疗期间,这些疫苗可能不安全或可能无法正常工作。
5、怀孕或计划怀孕。VENCLEXTA可能会伤害未出生的婴儿。如果您能够怀孕,应该在您开始使用VENCLEXTA治疗之前进行妊娠试验,并且您应该在治疗期间使用有效的避孕措施,并且在最后一次服用VENCLEXTA后至少30天。如果您怀孕或认为您怀孕了,请立即告诉主治医生。
6、目前尚不清楚VENCLEXTA是否会进入您的母乳。使用VENCLEXTA治疗期间不要进行母乳喂养。
研究者报告了一项前瞻性的Ib/II期临床试验结果。受试者的中位年龄为74岁,其中继发性急性髓性白血病(AML)患者占比49%,71%的患者接受去甲基化药物(HMAs)治疗,32%的患者具有细胞遗传学不良风险。
研究中常见的≥3级的不良反应为发热性中性粒细胞减少(42%)、血小板减少(38%)以及白细胞减少(34%)。
最常见的非血液学不良事件为恶心(70%)、腹泻(49%)、低钾血症(48%)和疲劳(43%)。
一、避免Venclexta与中度CYP3A抑制剂,强或中度CYP3A诱导剂,P-gp抑制剂,或狭窄治疗指数P-gp底物的同时使用。
二、如必须使用一种中度CYP3A抑制剂或一种P-gp抑制剂,减低Venclexta剂量至少50%。
三、如启动阶段后必须使用一种强CYP3A抑制剂,减低Venclexta剂量至少75%。
如必须使用一种狭窄治疗指数P-gp底物,它应在Venclexta前至少6小时前使用。
未曽用venetoclax进行致癌性研究。
在一项体外细菌致突变性(Ames)试验Venetoclax不是致突变性,在一个体外染色体畸变试验利用人外周血淋巴细胞不诱发数字或结构畸变,和在一项体内小鼠骨髓微核试验在剂量至835 mg/kg不是致染色体断裂。M27代谢物是阴性对在体外Ames和染色体畸变试验对遗传毒性活性。
在雄性和雌性小鼠进行生育力和早期胚胎发育研究。这些研究评价交配,受精,和胚胎发育至植入。Venetoclax对动情周期,交配,生育力,黄体,子宫植入物或或胚胎每窝在剂量至600 mg/kg/day没有影响。但是,根据在犬中在暴露低至在推荐剂量人AUC暴露0.5倍时观察到睾丸毒性(生殖细胞丢失)存在人男性生育力风险。

卡培他滨是医保用药吗?
卡培他滨Xeloda是胃肠道肿瘤患者的新希望,卡培他滨Xeloda用于联合化疗治疗晚期或转移性结直肠癌、晚期或转移性胃癌 。卡培他滨Xeloda适用于紫杉醇和包括有蒽环类抗生素化疗方案治疗无效的晚期原发性或转移性乳腺癌的进一步治疗。卡培他滨Xeloda在转移性乳腺癌一线治疗中的高效性得到公认。与传统静脉注射的化疗方案相对比,用口服卡培他滨Xeloda治疗转移性乳腺癌,能达到更好的总体有效果比率。另一项临床试验结果也显示,口服卡培他滨Xeloda的疗效优于传统静脉注射化疗药物紫杉醇。

依维替尼能否治疗难治性骨髓增生异常综合征?
美国食品和药物管理局(FDA)已授予TIBSOVO 依维替尼 (ivosidenib)治疗经FDA获批检测法验出携带IDH1突变的复发或难治性骨髓增生异常综合征(myelodysplastic syndrome,MDS)成人患者的突破性疗法资格认定。MDS是一组骨髓疾病,可导致感染和持续出血等严重并

伊沙佐米治疗多发性骨髓瘤的临床研究数据
随着新型药物和新的治疗手段涌现,多发性骨髓瘤(MM)的预后有了实质性的改善。 伊沙佐米 作为MM治疗中的首个口服蛋白酶体抑制剂(PI),其已经在60多个国家被批准用于既往接受过一种治疗方案的骨髓瘤患者。由于临床试验严格挑选入组患者,其对诊疗中心及研究设

伊沙佐米三联疗法能否用于治疗多发性骨髓瘤?
多发性骨髓瘤(MM)是一种恶性浆细胞病,目前治疗多采用靶向治疗,靶向药物精准作用于癌细胞上或癌细胞内的特定分子(如蛋白质)。2015年,FDA批准 伊沙佐米 用于治疗多发性骨髓瘤。2020年,在欧洲血液学协会(EHA)第25届大会上公布了评估口服蛋白酶体
依维替尼治疗IDH1突变的胆管癌患者有效吗?
依维替尼 已获批治疗IDH1突变复发性或难治性急性骨髓性白血病患者。随着依维替尼临床的深入,有望在胆管癌领域发挥更大的作用,为IDH1突变的胆管癌患者带来新的希望。 依维替尼 优先审查资格的授予是基于名为ClarIDHy的3期临床试验数据。ClarIDHy
伊沙佐米治疗骨髓瘤每周仅需口服一次吗?
伊沙佐米作为首个口服蛋白酶体抑制剂,每周仅需口服一次,有效提高患者依从性。FDA推荐伊沙佐米起始口服剂量为4 mg,一周一次,突破了现有蛋白酶抑制剂无法口服的局限性,有效解决了静脉给药困难人群的用药问题,对改善患者的生活质量具有重要意义。基于




